Ömer
Yönetici
KİMYASAL DENKLEMLER
• KİMYASAL DENKLEMLER
şeklindedir. Bu olayda reaksiyona giren ve çıkan atomsayıları birbirine eşittir.
Kimyasal reaksiyonlarda değişmeyen bazı özellikler.
Mol sayısı, molekül sayısı, basınç, hacim, sıcaklık değişebilir.
BASİT DENKLEM DENKLEŞTİRME
Karışık redoks reaksiyonlarının dışındaki denklemleri denkleştirmek için atom sayısı en fazla olan bileşiğin kat sayısı 1 olarak alınır. Diğerlerinin katsayısı buna bağlı olarak sayılarak bulunur.
DENKLEM KATSAYILARININ YORUMU ve ANLAMI
Bir kimyasal denklemde maddelerin baş tarafında bulunan katsayılar mol olarak yorumlanır.
Şayet reaksiyona giren ve oluşan maddelerin tamamı gaz olursa kat sayılar hacim (lt) olarak da yorumlanabilir.
N2(g) + 3H2(g) ® 2NH3(g) denklemi;
1 mol N2(g) ile 3 mol H2 tepkimeye girmiş 2 mol NH3 oluşmuştur. Şeklinde yorumlanır.
Bu denklemde maddelerin tamamı gaz olduğundan 1 hacim N2 ile 3 hacim H2 tepkimeye girmiş ve 2 hacim NH3 oluşmuş şeklinde de yorumlanabilir.
Ya da 1 lt N2 ile 3 lt H2 tepkimeye girerse 2 lt NH3 oluşur da denilebilir.
REAKSİYON TİPLERİ
1. Asit - Baz reaksiyonları
2. Metallerin asitlerle reaksiyonu
Zn + 2HCI ® ZnCI2+ H2(g)
Ag + HCI ®Reaksiyon vermez.
3. Metallerin bazlarla reaksiyonu
Kuvvetli bazlarla yalnızca anfoter metaller (Al, Zn, Sn, Pb ...) reaksiyon verir. Tuz oluşur. Hidrojen gazı açığa çıkar.
Zn + 2NaOH ® Na2 ZnO2 + H2(g)
AI + 3NaOH ®Na3AIO3 + 3/2 H2(g)
4. Organik bileşiklerin yanma reaksiyonu
Hidrokarbon; yapısında C ve H atomu bulunduran bileşiklerdir. Bazı organik bileşiklerin yapısında C - H - O atomları bulunur. Organik bileşiklerin yanmasından CO2 ve H2O oluşur.
C3H6 + 9/2 O2 ® 3CO2 + 3H2O
C2H5 OH + 3O2 ® 2CO2 + 3H2O
5. Yer değiştirme reaksiyonları
Aktiflik: Metallerin elektron verebilme, ametallerin elektron alabilme kabiliyetine aktiflik denir.
Aktif olan bir metal daha pasif olan metal katyonu ile yer değiştirir.Fe(k) + 2AgNO3(ag)® Fe(NO3)2(ag) + 2Ag(k)
6. Aktif metallerin su ile reaksiyonu
Li K Ba Sr Ca Na gibi aktif metallerin su ile reaksiyonundan hidrojen gazı açıga çıkarken metal hidroksit oluşur.
Na + H2O ® NaOH + 1/2 H2(g)
7. Analiz (Ayrışma) Reaksiyonları
Bir bileşiğin kendisinden daha basit maddelere ayrıştırılmasına analiz denir.
Aşağıdaki denklemler analiz reaksiyonlarına örnek olarak verilebilir.
CaCO3 + ısı ® CaO + CO2(g)
elektroliz
H2O ¾¾¾®H2 + 1/2 O2
8. Sentez (Birleşme) reaksiyonları
Birden fazla maddenin birleşerek yeni özellikte yeni bir madde oluşturması olayına sentez denir.
H2 + 1/2 O2 ® H2O
N2 + 3H2 ® 2NH3
Redoks Reaksiyonları
Kimyasal reaksiyonların birçoğunda reaksiyona giren maddeler arasında elektron alışverişi olur. Böyle reaksiyonlara redoks reaksiyonları denir.
Redoks, yükseltgenme (elektron verme) ve indirgenme (elektron alma) olaylarının birleşimidir.
Elektron veren atom kendisi yükseltgenirken karşısındakini indirgediğinden dolayı indirgendir. Elektron alan atom kendisi indirgenirken karşısındakini yükseltgediği için yükseltgendir.
Yükseltgenme (Elektron verme)
Al0 ®Al+3 + 3e-
3e- vermiş, ya da 3e-ile yükseltgenmiş
Cl-1 ® Cl+7+ 8e-
8e- vermiş, ya da 8e-ile yükseltgenmiş
2Cl ®Cl2 + 2e-
2e- vermiş, ya da 2e-ile yükseltgenmiş
S3-2® 3S+6 + 24e-
24e- vermiş, ya da 24e-ile yükseltgenmiş
İndirgenme (Elektron alma)
Mg+2 + 2e- ®Mg0 2e-
almış ya da 2e- ile indirgenmiş
P+5 + 2e-®P+32e-
almış ya da 2e- ile indirgenmiş
N2 + 6e- ®2N-36e-
almış ya da 6e- ile indirgenmiş
Redoks Denklemlerinin Denkleştirilmesi
Sırası ile şu işlemler yapılmalıdır;
Örnek - 1
KMnO4 + HCI ® KCI + MnCI2 + CI2 + H2O
denklemini en küçük tam sayılarla denkleştiriniz.
Çözüm
Elementlerin denklemde değerliklerini bulalım.
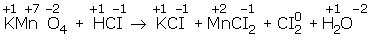
Değerlik değiştiren elementler Mn ve CI dir. Mn+7 den Mn+2 ye indirgenmiş, CI- den CI20 a yükseltgenmiştir. indirgenme ve yükseltgenme yarı reaksiyonlarını yazalım.
Mn+7 + 5e-® Mn+2 (indirgenme)
2CI- ® CI02 + 2e– (yükseltgenme)
Elektron sayılarını eşitlemek için indirgenme yarı reaksiyonunu 2, yükseltgenme yarı reaksiyonunu 5 ile çarpalım.
2/ Mn+7 + 5e- ® Mn+2 (indirgenme)
5/ 2CI- ®CI2 + 2e– (yükseltgenme)
2Mn+7 + 10CI– ® 2Mn+2 + 5CI2
ürünlerin katsayılarını esas denkleme yazalım.
KMnO4 + HCI ® KCI + 2MnCI2 + 5CI2 + H2O
Sağ tarafta 2 tane Mn vardır. KMnO4 ün katsayısı 2 olursa sol taraftaki Mn’de 2 tane olur.
Solda 2K vardır, sağdaki KCI nin katsayısı 2 olmalıdır.
Klor atomları sağ tarafta toplam 16 tane vardır. HCI nin katsayısı 16 olmalıdır.
Solda 16 tane H atomu varsa, H2O nun katsayısı 8 olmalıdır.
Denklemin denkleştirilmiş hali;2KMnO4+16HCI ® 2KCI+ 2MnCI2 + 5CI2 + 8H2O
şeklinde olur.
Örnek - 2
Asidik ortamda gerçekleşen
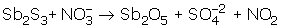
tepkimesini en küçük katsayılarla denkleştiriniz?
Çözüm
Elementlerin değerlikleri bulunur.
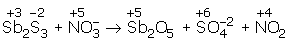
Değerlik değiştiren elementler Sb, S ve N’dur.
Sb ve S yükseltgenirken verdikleri elektronları N alarak indirgenmiştir.
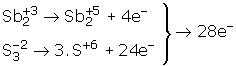
N+5 + e–® N+4
Elektron sayılarını eşitlemek için yükseltgenme yarı reaksiyonlarını 1 ile, indirgenme yarı reaksiyonunu 28 ile çarpalım.
1/Sb2+3 ® Sb2 + 4e’. (Yükseltgenme)
1/S2-2® 3.S+6 + 24e (Yükseltgenme)
28/N+5 + le’® N+4 (İndirgenme)
_______________________________
ürünlerin kat sayılarını esas denkleme yazalım.
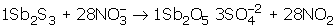
İyonik olduğu için yük denkliği eşitlenmeli. Soruda verilen iyonlar esas alınarak asitli ortam olduğu için H+ ve H2O yazılacak. Girenlerin yük toplamı (– 28), çıkanların yük toplamı (–6). Yükleri eşitlemek için girenler tarafına 22 H+ yazılmalıdır. 22 H+ yazılınca H eşitliğini sağlamak için çıkanlar tarafına 11 H2O yazılmalıdır.
Denklemin denkleşmiş hali,
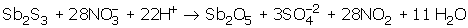
şeklinde olur.
• KİMYASAL DENKLEMLER
- İki ya da daha fazla maddenin birbirleri ile etkileşerekkendi özelliklerini kaybedip yeni özelliklerde bir takım ürünler meydana getirmesinekimyasal olay, bunların formüllerle gösterilmesine kimyasal denklemdenir. Kimyasal denklemlerde (®) işaretinin soltarafında reaksiyona girenler, sağ tarafında da ürünler bulunur.
- Hidroklorik asit ve sodyum hidroksitin reaksiyonundanyemek tuzu ve su meydana gelir. Bu kimyasal olayın denklemi
şeklindedir. Bu olayda reaksiyona giren ve çıkan atomsayıları birbirine eşittir.
Kimyasal reaksiyonlarda değişmeyen bazı özellikler.
- Atom sayısı ve cinsi
- Toplam kütle
- Toplam proton sayısı
- Toplam nötron sayısı
- Toplam elektron sayısı
- Kütle numaraları
- Çekirdek kararlılıkları
Mol sayısı, molekül sayısı, basınç, hacim, sıcaklık değişebilir.
BASİT DENKLEM DENKLEŞTİRME
Karışık redoks reaksiyonlarının dışındaki denklemleri denkleştirmek için atom sayısı en fazla olan bileşiğin kat sayısı 1 olarak alınır. Diğerlerinin katsayısı buna bağlı olarak sayılarak bulunur.
DENKLEM KATSAYILARININ YORUMU ve ANLAMI
Bir kimyasal denklemde maddelerin baş tarafında bulunan katsayılar mol olarak yorumlanır.
Şayet reaksiyona giren ve oluşan maddelerin tamamı gaz olursa kat sayılar hacim (lt) olarak da yorumlanabilir.
N2(g) + 3H2(g) ® 2NH3(g) denklemi;
1 mol N2(g) ile 3 mol H2 tepkimeye girmiş 2 mol NH3 oluşmuştur. Şeklinde yorumlanır.
Bu denklemde maddelerin tamamı gaz olduğundan 1 hacim N2 ile 3 hacim H2 tepkimeye girmiş ve 2 hacim NH3 oluşmuş şeklinde de yorumlanabilir.
Ya da 1 lt N2 ile 3 lt H2 tepkimeye girerse 2 lt NH3 oluşur da denilebilir.
REAKSİYON TİPLERİ
1. Asit - Baz reaksiyonları
- Asit ve bazların reaksiyonundan tuz ve su oluşur. Olayanötürleşme denir. Su oluşurken asidin H+ iyonu ile bazın OH-iyonu birleşir.
- Asitoksitlerin bazlarla, bazik oksitlerin asitlerle ve asit oksitlerin bazikoksitlerle reaksiyonları da asit baz reaksiyonudur.
CO2 + 2NaOH ®Na2CO3 + H2O - Anhidrobazolan NH2 ün asitlerle reaksiyonundanyalnız tuz oluşur.
2NH3 + H2SO4 ®(NH4)2SO4 - Na2CO3 ve CaCO3 gibibazik tuzların asitlerle reaksiyonundan tuz ve su oluşur, CO2 gazıaçıga çıkar.
2. Metallerin asitlerle reaksiyonu
- Hidrojenden aktif metallerin asitlerle reaksiyonundantuz oluşur. Hidrojen gazı açıga çıkar.
Zn + 2HCI ® ZnCI2+ H2(g)
- Soy ve yarı soy metallere oksijensiz asitler etki etmez.
Ag + HCI ®Reaksiyon vermez.
- Yarısoy metallere (Cu - Hg - Ag) HNO3 ve H2SO4gibi asitler yükseltgen özellikte etki ederler. Reaksiyon sonucu H2gazı açıga çıkmaz.
3. Metallerin bazlarla reaksiyonu
Kuvvetli bazlarla yalnızca anfoter metaller (Al, Zn, Sn, Pb ...) reaksiyon verir. Tuz oluşur. Hidrojen gazı açığa çıkar.
Zn + 2NaOH ® Na2 ZnO2 + H2(g)
AI + 3NaOH ®Na3AIO3 + 3/2 H2(g)
4. Organik bileşiklerin yanma reaksiyonu
Hidrokarbon; yapısında C ve H atomu bulunduran bileşiklerdir. Bazı organik bileşiklerin yapısında C - H - O atomları bulunur. Organik bileşiklerin yanmasından CO2 ve H2O oluşur.
C3H6 + 9/2 O2 ® 3CO2 + 3H2O
C2H5 OH + 3O2 ® 2CO2 + 3H2O
5. Yer değiştirme reaksiyonları
Aktiflik: Metallerin elektron verebilme, ametallerin elektron alabilme kabiliyetine aktiflik denir.
Aktif olan bir metal daha pasif olan metal katyonu ile yer değiştirir.Fe(k) + 2AgNO3(ag)® Fe(NO3)2(ag) + 2Ag(k)
- Aktif olan bir ametal daha pasif olan ametal anyonu ileyer değiştirir.
- Anyon ve katyon her ikisi de yer değiştirir.
6. Aktif metallerin su ile reaksiyonu
Li K Ba Sr Ca Na gibi aktif metallerin su ile reaksiyonundan hidrojen gazı açıga çıkarken metal hidroksit oluşur.
Na + H2O ® NaOH + 1/2 H2(g)
7. Analiz (Ayrışma) Reaksiyonları
Bir bileşiğin kendisinden daha basit maddelere ayrıştırılmasına analiz denir.
Aşağıdaki denklemler analiz reaksiyonlarına örnek olarak verilebilir.
CaCO3 + ısı ® CaO + CO2(g)
elektroliz
H2O ¾¾¾®H2 + 1/2 O2
8. Sentez (Birleşme) reaksiyonları
Birden fazla maddenin birleşerek yeni özellikte yeni bir madde oluşturması olayına sentez denir.
H2 + 1/2 O2 ® H2O
N2 + 3H2 ® 2NH3
Redoks Reaksiyonları
Kimyasal reaksiyonların birçoğunda reaksiyona giren maddeler arasında elektron alışverişi olur. Böyle reaksiyonlara redoks reaksiyonları denir.
Redoks, yükseltgenme (elektron verme) ve indirgenme (elektron alma) olaylarının birleşimidir.
Elektron veren atom kendisi yükseltgenirken karşısındakini indirgediğinden dolayı indirgendir. Elektron alan atom kendisi indirgenirken karşısındakini yükseltgediği için yükseltgendir.
Yükseltgenme (Elektron verme)
Al0 ®Al+3 + 3e-
3e- vermiş, ya da 3e-ile yükseltgenmiş
Cl-1 ® Cl+7+ 8e-
8e- vermiş, ya da 8e-ile yükseltgenmiş
2Cl ®Cl2 + 2e-
2e- vermiş, ya da 2e-ile yükseltgenmiş
S3-2® 3S+6 + 24e-
24e- vermiş, ya da 24e-ile yükseltgenmiş
İndirgenme (Elektron alma)
Mg+2 + 2e- ®Mg0 2e-
almış ya da 2e- ile indirgenmiş
P+5 + 2e-®P+32e-
almış ya da 2e- ile indirgenmiş
N2 + 6e- ®2N-36e-
almış ya da 6e- ile indirgenmiş
Redoks Denklemlerinin Denkleştirilmesi
Sırası ile şu işlemler yapılmalıdır;
- Değerlik değiştiren elementler tespit edilerek her ikitaraftaki değerlikleri bulunur.
- Yükseltgenme ve indirgenme yarı tepkimeleri ayrı ayrıyazılır.
- Verilen elektron sayısı alınan elektron sayısına eşitolması gerektiğinden uygun katsayılar kullanılarak elektron eşitliği sağlanır.
- Reaksiyon, iyon reaksiyonu ise (asidik ortamda ya dabazik ortamda gerçekleşen bir tepkime ise) H+ ya da OH-iyonları ekleyerek veya denklem üzerinde H+ ya da OH- iyonlarıgözüküyorsa bunların katsayıları değiştirilerek yük denkliği sağlanır. Gereklitarafa H2O yazılır.
- Reaksiyona giren atomların cins ve sayısı, reaksiyondançıkan atomların cins ve sayısına eşit olması gerektiğinden dolayı atom eşitliğisağlanmamış atomlar uygun katsayılarla eşitlenir.
Örnek - 1
KMnO4 + HCI ® KCI + MnCI2 + CI2 + H2O
denklemini en küçük tam sayılarla denkleştiriniz.
Çözüm
Elementlerin denklemde değerliklerini bulalım.
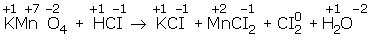
Değerlik değiştiren elementler Mn ve CI dir. Mn+7 den Mn+2 ye indirgenmiş, CI- den CI20 a yükseltgenmiştir. indirgenme ve yükseltgenme yarı reaksiyonlarını yazalım.
Mn+7 + 5e-® Mn+2 (indirgenme)
2CI- ® CI02 + 2e– (yükseltgenme)
Elektron sayılarını eşitlemek için indirgenme yarı reaksiyonunu 2, yükseltgenme yarı reaksiyonunu 5 ile çarpalım.
2/ Mn+7 + 5e- ® Mn+2 (indirgenme)
5/ 2CI- ®CI2 + 2e– (yükseltgenme)
2Mn+7 + 10CI– ® 2Mn+2 + 5CI2
ürünlerin katsayılarını esas denkleme yazalım.
KMnO4 + HCI ® KCI + 2MnCI2 + 5CI2 + H2O
Sağ tarafta 2 tane Mn vardır. KMnO4 ün katsayısı 2 olursa sol taraftaki Mn’de 2 tane olur.
Solda 2K vardır, sağdaki KCI nin katsayısı 2 olmalıdır.
Klor atomları sağ tarafta toplam 16 tane vardır. HCI nin katsayısı 16 olmalıdır.
Solda 16 tane H atomu varsa, H2O nun katsayısı 8 olmalıdır.
Denklemin denkleştirilmiş hali;2KMnO4+16HCI ® 2KCI+ 2MnCI2 + 5CI2 + 8H2O
şeklinde olur.
Örnek - 2
Asidik ortamda gerçekleşen
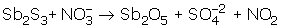
tepkimesini en küçük katsayılarla denkleştiriniz?
Çözüm
Elementlerin değerlikleri bulunur.
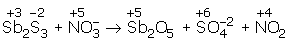
Değerlik değiştiren elementler Sb, S ve N’dur.
Sb ve S yükseltgenirken verdikleri elektronları N alarak indirgenmiştir.
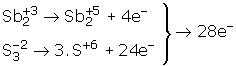
N+5 + e–® N+4
Elektron sayılarını eşitlemek için yükseltgenme yarı reaksiyonlarını 1 ile, indirgenme yarı reaksiyonunu 28 ile çarpalım.
1/Sb2+3 ® Sb2 + 4e’. (Yükseltgenme)
1/S2-2® 3.S+6 + 24e (Yükseltgenme)
28/N+5 + le’® N+4 (İndirgenme)
_______________________________
ürünlerin kat sayılarını esas denkleme yazalım.
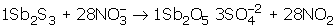
İyonik olduğu için yük denkliği eşitlenmeli. Soruda verilen iyonlar esas alınarak asitli ortam olduğu için H+ ve H2O yazılacak. Girenlerin yük toplamı (– 28), çıkanların yük toplamı (–6). Yükleri eşitlemek için girenler tarafına 22 H+ yazılmalıdır. 22 H+ yazılınca H eşitliğini sağlamak için çıkanlar tarafına 11 H2O yazılmalıdır.
Denklemin denkleşmiş hali,
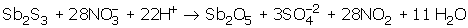
şeklinde olur.
Son düzenleme: