Ömer
Yönetici
REAKSİYON HIZI
Birim zamanda reaksiyona girenlerin yada ürünlerin miktarlarındaki değişmeye reaksiyon hızı denir. N2 + 3H2 ® 2NH3 reaksiyona göre;

Hızlar arasındaki ilişki
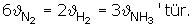
Potansiyel Enerji Tepkime Koordinatı Grafikleri
Bir tepkimenin gerçekleşebilmesi için,
Grafiğin yorumu
2X(g) + Y(s) ® Z(g) + T(k) V = k . [X]2
Not : Katı ve saf sıvıların derişimleri sabit olduğundan hız ifadesinde yazılmazlar. k: Her reaksiyon için farklı olan bir sabittir.
Katalizör : Başlamış bir reaksiyona herhangi bir anda girerek reaksiyonun aktifleşme enerjisini düşürüp reaksiyonu hızlandıran daha sonra kendisinde hiçbir değişiklik olmadan elde edilen maddeye katalizör madde denir.
Katalizörler bir tepkimeyi başlatamazlar, başlamış tepkimeyi durduramazlar. tepkimenin yönünü değiştiremezler, ürün miktarına etki etmezler, tepkimenin DH’ını değiştiremezler. Ancak; tepkimenin aktifleşme enerjisini değiştirirler, k sabitini değiştirirler ve tepkimenin mekanizmasını değiştirebilirler. Not : Canlı organizmalarda katalizör görevi yapan enzimler vardır, bu arada reaksiyonu yavaşlatan inhibritörler vardır.
Çözüm
Birim zamanda reaksiyona girenlerin yada ürünlerin miktarlarındaki değişmeye reaksiyon hızı denir. N2 + 3H2 ® 2NH3 reaksiyona göre;

Hızlar arasındaki ilişki
Potansiyel Enerji Tepkime Koordinatı Grafikleri
Bir tepkimenin gerçekleşebilmesi için,
- Reaksiyona giren moleküller çarpışmalıdır.
- Her çarpışma reaksiyonla sonuçlanmaz, uygun çarpışma olması gerekir.
- Çarpışan moleküllerin belirli bir enerjiye sahip olmaları gerekir. Bu enerji reaksiyonunun gerçekleşebilmesi için gerekli olan minimum enerjidir. (Aktifleşme enerjisidir.)

Grafiğin yorumu
- Reaksiyona girenlerin enerjisi 0 k.kal’dir.
- Ürünlerin enerjisi -50 k.kal’dir.
- Eai = 70 k.kal Eag = 120 k.kal’dir. DH = -50 k.kal’dir.
- DH = Eai - Eag
- Yüksek sıcaklıkta girenler kararlıdır. Düşük sıcaklıkta ürünler kararlıdır.
2X(g) + Y(s) ® Z(g) + T(k) V = k . [X]2
Not : Katı ve saf sıvıların derişimleri sabit olduğundan hız ifadesinde yazılmazlar. k: Her reaksiyon için farklı olan bir sabittir.
- Derişim : Reaksiyona giren maddelerin derişimleri değiştirilirse hız da değişir.
- Basınç - Hacim : Basıncın değişmesi hacmin değişmesine bağlı olarak düşünülmelidir. Hacim değişirse reaksiyona giren tüm madde derişimleri değişeceğinden hız da değişir.
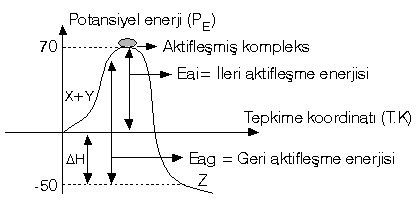
- Sıcaklık : Sıcaklığın arttırılması bütün tepkimelerin hızını arttırır.
- Moleküllerinin hareket hızı artar.
- Çarpışma sayısı artar.
- Ortalama kinetik enerji artar.
- Aktifleşmiş kompleks sayısı artar.
- k sabiti büyür.

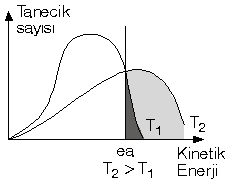
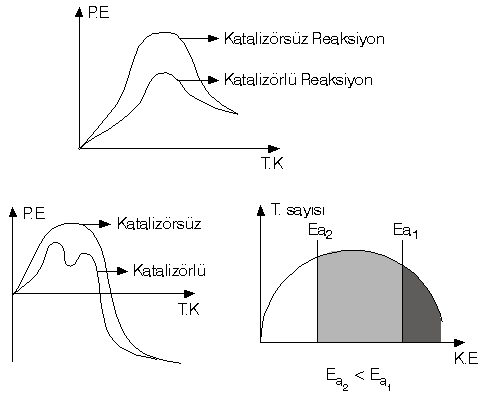
Katalizör : Başlamış bir reaksiyona herhangi bir anda girerek reaksiyonun aktifleşme enerjisini düşürüp reaksiyonu hızlandıran daha sonra kendisinde hiçbir değişiklik olmadan elde edilen maddeye katalizör madde denir.

Katalizörler bir tepkimeyi başlatamazlar, başlamış tepkimeyi durduramazlar. tepkimenin yönünü değiştiremezler, ürün miktarına etki etmezler, tepkimenin DH’ını değiştiremezler. Ancak; tepkimenin aktifleşme enerjisini değiştirirler, k sabitini değiştirirler ve tepkimenin mekanizmasını değiştirebilirler. Not : Canlı organizmalarda katalizör görevi yapan enzimler vardır, bu arada reaksiyonu yavaşlatan inhibritörler vardır.
- Temas Yüzeyi : Reaksiyona giren katı yada sıvıların temas yüzeyini arttırmak, reaksiyonun hızlanmasına sebep olur. Temas yüzeyini arttırmak derişimleri değiştirmeyeceğinden k sabitinin değişmesine sebep olur.
- Maddenin Cinsi
- İyon reaksiyonları diğer reaksiyonlara göre daha hızlı gerçekleşir.
- Organik reaksiyonlar diğer reaksiyonlara göre daha yavaş gerçekleşir.
- Reaksiyona giren madde çeşidi ve katsayı arttıkça reaksiyon daha yavaş gerçekleşir.
Çözüm
- Ara ürün reaksiyonun birisinde ürün iken diğerinde reaktif konumun da olan maddelere denir. HOCl, OH–, HOI ara üründür.
- Katalizör reaksiyona girip değişikliğe uğramadan çıkan maddelere denir. H2O katalizördür.
- Kademeli reaksiyonlarda hız denklemi yavaş basamağa göre yazılır.
- Kademeli reaksiyonlarda hızı, yavaş basamaktaki maddelerin derişimlerinin değiştirilmesi sonucunda değişir. Ancak saf H2O ilavesi çözeltisinin hacmini artıracağından yavaş basamaktaki I– ve HOCl derişimleri azalır ve hız küçülür.
- Renk değişimi olan reaksiyonlarda renk değişimiyle hız takip edilebilir.
- İyon reaksiyonlarında elektrik iletkenliği ölçülerek hız takip edilebilir.
- Gaz reaksiyonlarında ise reaksiyon giren mol sayısı ürünlerin mol sayısından farklı ise basınç değişimiyle ölçülebilir.
Son düzenleme: